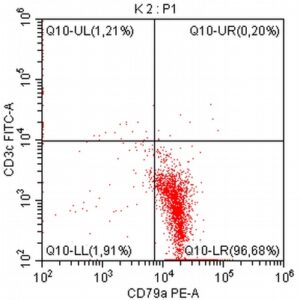
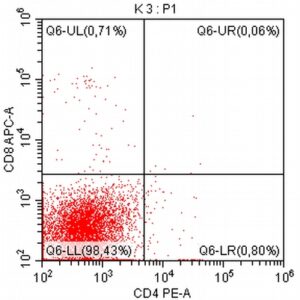
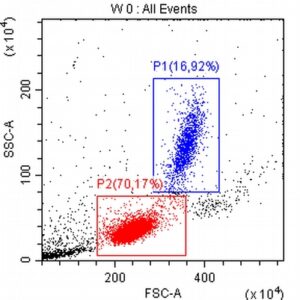
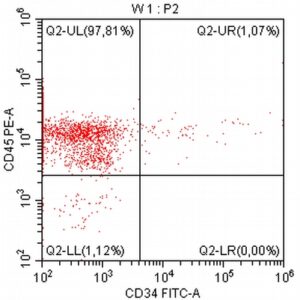
Pomysłodawcą i opiekunem merytorycznym projektu
jest dr n. wet. Dariusz Jagielski.
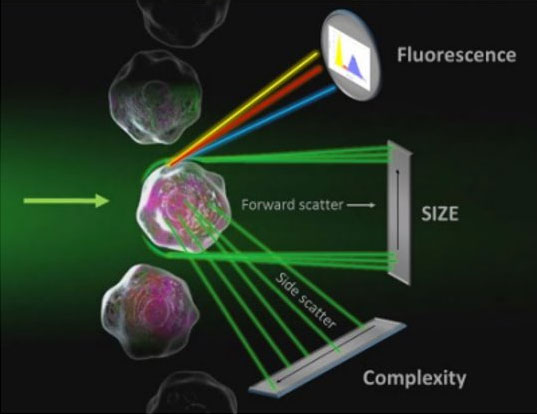
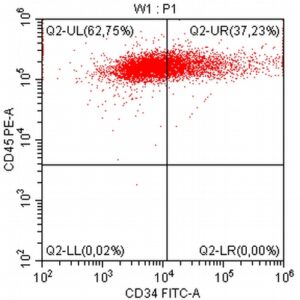
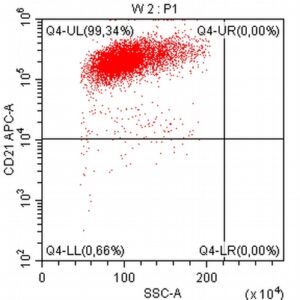
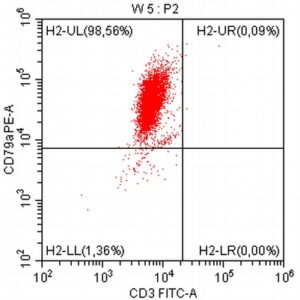
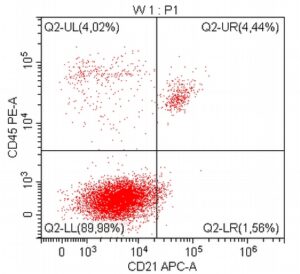
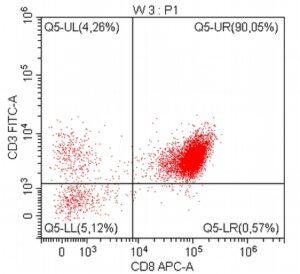
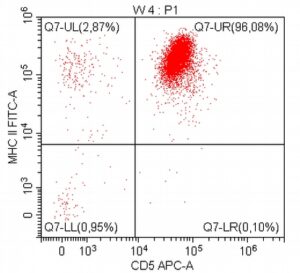
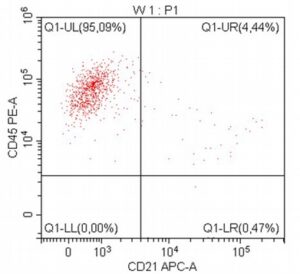
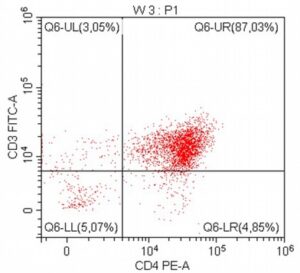
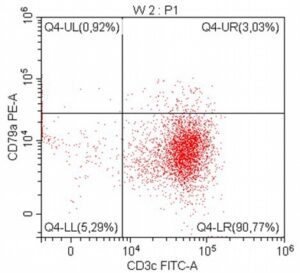
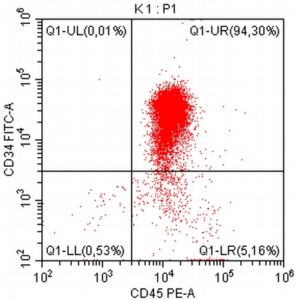
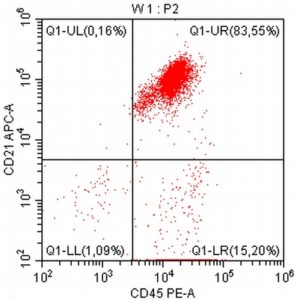
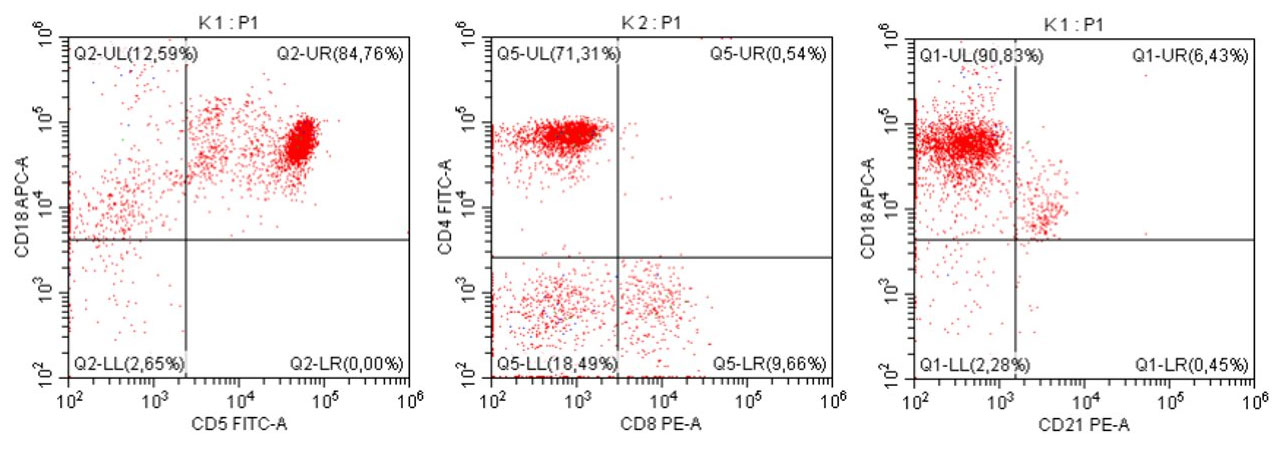
„Na początku mojej pracy z pacjentami onkologicznymi, niemal dwadzieścia lat temu, zajmowałem się immunofenotypowaniem i cytometrią przepływową, będąc oczarowanym potencjałem tej metody diagnostycznej. Wreszcie udało się zebrać w naszym kraju grupę osób, które oferują cytometrię przepływową jako standardowe i komercyjne badanie diagnostyczne dla pacjentów z nowotworami układu krwiotwórczego. Założeniem całości jest bezpośredni kontakt z lekarzem zajmującym się pacjentem – to z pewnością będzie skutkowało uzyskaniem z badania cytometrycznego dodatkowych i przydatnych klinicznie informacji.”